测序反应通用试剂:保留了身份,废掉了“功能”
管松了无法无天,管严了原地暴毙?
——监管也挺难
昨天行业里有一份重要的文件,相信大家都看过了
《二代基因测序相关体外诊断试剂分类界定指导原则(征求意见稿)》
其中最引人注目的,是“测序反应通用试剂”在消失近一年后的回归。
政策解读有很多朋友做了,比如九哥的这篇,来龙去脉都很清晰
300+测序反应通用试剂盒的 I 类身份,又“失而复得”?
我们换个角度,揣摩一下这份文件背后的导向。
通俗的表示就是:
此次回归的监管变化,目的是什么?
PS:这篇仅代表个人观点。如果我俩理解不一样,那么你是对的。欢迎留言区探讨。
01
“初心”
文件公布的第一时间,就有不少朋友在喜迎“测序通用反应试剂”的回归。
对此,五星评论家麦克阿瑟表示:切忌半场开香槟。
“回归”自然不假,但对于“回归”的理解,可能不太一样。
我的理解是:指导原则的核心目的,是让测序反应通用试剂回归初心。
那,什么是初心?
NGS的全流程包括了提取、纯化、建库、测序反应、分析。
也就是说:
不管监管界定“测序反应试剂”是I类还是III类,它本来就是存在的。要想实现NGS全流程的合规监管,就一定要给其一个“身份”。
但既往这个身份拿的过于容易,就滋生出了灰区。
就如九哥所言:
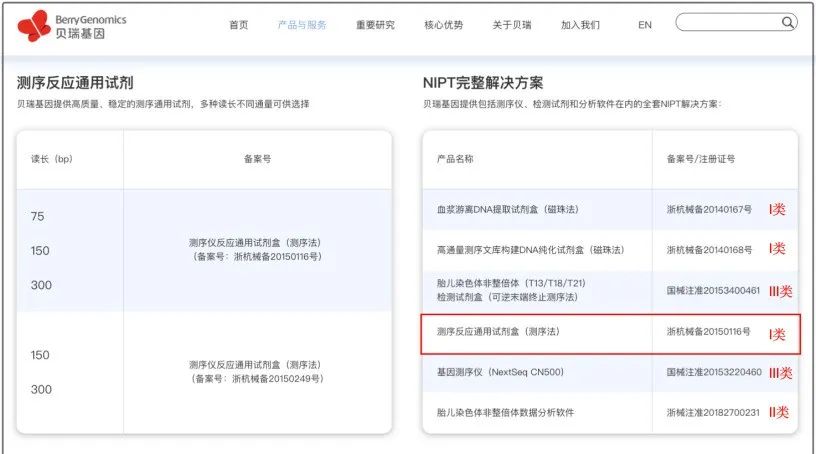
业内朋友知道,“测序反应通用试剂盒”,并不是一个简单的I类试剂(此前);在很多时候,它还承载了商业合作中的“更多功能”。
九哥的小九九,公众号:基因江湖消失的“测序反应通用试剂盒”,347款产品何去何从?
既往很多张I类证的备案是出于什么考量,大家都不用揣着明白装糊涂。
这在实践中带来的是不公平,对认真报3类证、做临床验证、走合规进院的企业,是不公平的。
“凭什么在投入完全不在一个量级的情况下,3类证和1类证有类似的商业价值?”
是时候让它更纯粹一点了。
顺着这个思路,就能理解这次征求意见稿为什么这么写。
02
“回归”
任何产品的监管,在有历史包袱的情况下,都不适合一刀切。
“打蛇,打七寸”
在测序反应通用试剂已经存在“乱象”的前提下,监管选择的是:
1. 继续保留了其单独备案的路径和I类身份
对于已经持有三类建库试剂注册证的企业,依然可以通过备案一张一类注册证实现全流程合规。
2. 通过加“限制条件”缩窄一类证的独立发挥空间
需要有“明确配套使用的文库构建试剂”和“明确适配的仪器品牌、型号(需适配医疗器械注册证有效期内的二代基因测序仪器)”
这在既往的实践中存在很大的弹性空间:
有的地方局并不把“适用机型”作为审查项目,有的则严格按照《体外诊断试剂说明书编写指导原则》来要求。
这次国家局算是把尺度给统一了。
让测序反应通用试剂回归成为全流程的一部分,而不再能作为一个悬浮的独立主体。
换句话说,假如你能备案一张1类证,那么意味着你一定有一张3类证(或者有非常强合作的3类证)。
这会带来的影响是:
单独备案一张1类证就擦边商业化的情况,从合规上就不成立了。
更深的影响是:
在有3类证的情况下,本质上也不需要再“借道”1类证去商业化。
“这个灰区空间不存在后,大家还有动力这么去做吗?”
3. 鼓励联合申报,但保留了灵活性
这一段来自于基因江湖九哥的聊天。
在征求意见稿中“鼓励二者(测序反应通用试剂和文库构建试剂)组成同一注册单元”,但依然保留了拆分的做法。
这个灵活性在“已获证三类证增加适用机型上”会得到很好的延展。
如果a(测序反应通用试剂)和b(文库构建试剂)必须组成同一注册单元申报一张三类注册证,一旦增加适用机型,可能因为a的组分会发生变化而不得不“重新注册”。
而拆分后,可以变成a1*b1,a2*b1....这样的组合,变更时更为“简单”,避免了“牵一发而动全身”。
三招下来,监管的意图已经很清晰了:
保留测序反应试剂作为全流程合规组成部分的身份,但斩断其成为商业化“快速捷径”的功能。
可以这么说:
过去的“测序反应通用试剂”,看似还“活着”,但实际已经“死了”。
03
“平衡”
总体来看,这次的征求意见稿在测序反应通用试剂的处理上展现了非常棒的监管艺术。
——管太松必然让大家无法无天,而管太严也容易让大家死给他看。
通过“做平衡”,给出了引导的选择题而非判断题。
但需要知道,“平衡”只是为了一起解决历史遗留问题,而不是为了创造新的问题。
——这是监管的勇气和担当,正视了既往的监管盲区/灰区,并未将全部责任都归咎为企业,而是和企业站在了一起。
给监管点一个大大的赞!
但作为企业也要懂味。
成年人的游戏,有些默契不要轻易打破,更不要视而不见。
如果在这个时间点还非要顶风,妄图去“重走历史的老路”。
那么,你离成为那个被解决的问题,也就不远了。
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。